3月16日,四川大学作为第一研究机构在《自然》(Nature)杂志上,以Article形式在线发表了题为Deletions linked to Tp53 loss drive cancer through p53-independent mechanisms的癌症研究新成果。
该成果由四川大学与美国斯隆凯特琳癌症中心共同完成,四川大学华西医院生物治疗国家重点实验室刘玉研究员、陈崇研究员为论文的共同第一作者,美国纪念斯隆凯特琳癌症中心Scott W. Lowe博士为文章的通讯作者。
据介绍,此项研究成果首次直接证明了染色体大片段缺失是肿瘤发生的驱动,并阐述了其机理为同一染色体片段上有多个协同作用的肿瘤抑制基因。这一研究构建了新型的染色体异常的肿瘤模型,为这类疾病的靶向治疗提供了基础,为解析更为广泛的染色体异常在人类重大疾病中的作用和相应的转化研究提供了蓝图。
《Nature》以长篇论文(即“Article”)和短篇报道(即“Letter”)两种形式发表世界科学研究的最新重大成果。通常来说,Letter是对某一原始科研成果的初步介绍;Article是对某一项研究工作的更全面、更周密的介绍,代表着人们对某一事物认识层次的一个显著提高。
染色体(Chromosome )是细胞内具有遗传性质的物体,人体共有46条,基因则位于染色体上。染色体的异常是肿瘤发生的标志之一,但它们在肿瘤发生发展中的具体作用目前还不清楚。在约1/3的人类肿瘤中,第17号染色体的长臂(染色体17p)都是缺失的,该长臂上含有多个肿瘤抑制基因。之前人们将染色体17p的缺失等同于肿瘤抑制基因Tp53的丢失,其中肿瘤抑制基因Tp53位于染色体17p上。
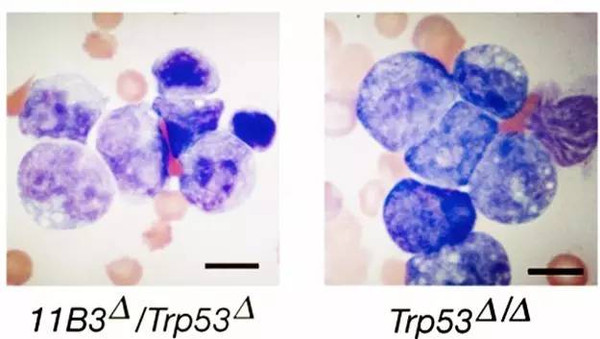
在这项研究中,刘玉、陈崇等通过基因工程构建了小鼠染色体11B3条件性敲除的新型模式动物,其中小鼠染色体11B3与人类染色体17p13.1是同线性的。该研究分别在淋巴瘤和白血病中证实了染色体17p缺失产生的肿瘤促进作用比Tp53缺失产生的要强。他们还进一步利用RNA干扰高通量文库筛选等技术,发现了染色体17p上新的肿瘤抑制基因ALOX15B等,并阐明了这些肿瘤抑制基因与Tp53协同作用,即能共同抑制肿瘤的发生。
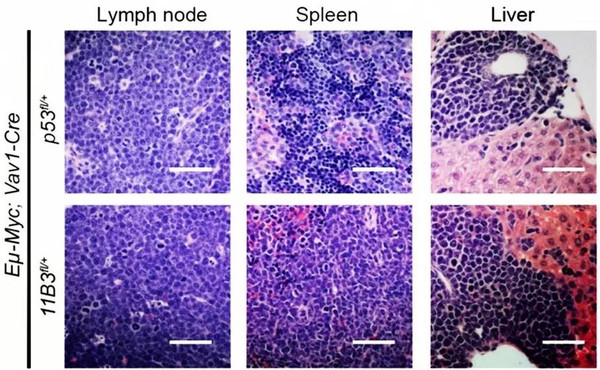
刘玉、陈崇等的研究首次直接证明了染色体大片段缺失是肿瘤发生的驱动,因为同一染色体片段上有多个协同作用的肿瘤抑制基因,而这些肿瘤抑制基因能够抑制肿瘤的发生。此外,这一研究还构建了新型的染色体异常肿瘤模型,为这类疾病的靶向治疗提供了基础,为解析染色体异常在人类重大疾病中的作用和相应的转化研究提供了蓝图。
延伸阅读:
突变使得肿瘤抑制基因Tp53丧失功能是人类癌症中最常见的事件,往往是通过“两次击中”机制而出现,涉及到一个等位基因错义突变,及包含另一个等位基因的染色体发生称作为“杂合子丢失”( loss of heterozygosity)的片段缺失。尽管Tp53错义突变也可以导致功能获得性活性而影响肿瘤进展,但目前尚不清楚除了Tp53丢失外,通常涉及许多基因的缺失事件是否影响了肿瘤的发生。
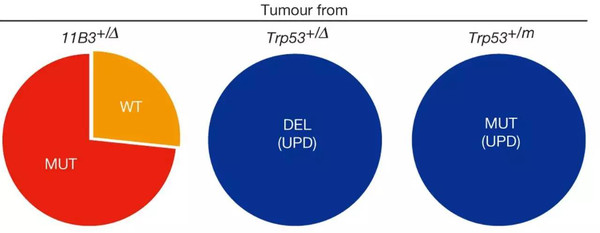
在Deletions linked to Tp53 loss drive cancer through p53-independent mechanisms中,研究人员证实人类17p13.1的线性区域——4Mb的小鼠染色体11B3发生体细胞杂合缺失,相比Trp53缺失对淋巴瘤和白血病形成造成了更大的影响。机制研究证实,11B3缺失对肿瘤发生的影响与Eif5a和Alox15b(也叫做Alox8)基因共同缺失有关,这些基因受抑与Trp53缺失协同作用可导致更具侵袭性的癌症。
新研究提供了令人信服的证据证实,在Tp53丢失的效应之外17p缺失赋予了其他的表型。考虑到某些Trp53错义突变已确立的功能获得性特性,研究结果表明这一在癌症中最常见的体细胞事件促成了多种活性,它们独立于Trp53失活发挥作用驱动了肿瘤发生。因此,看起来有可能包含Tp53损伤的肿瘤是根据Tp53突变的特性及17p缺失的程度生成了不同的表型。