人乳头瘤病毒(HpV)是已知唯一专性侵染人体上皮细胞的致癌病毒,不仅是导致女性子宫颈癌的元凶,还与乳腺癌、直结肠癌、肺癌、头颈癌、口腔癌等常见致命癌症密切相关。健康的人体免疫系统在绝大多数情况下能够有效控制HpV感染造成的危害。全球流行病学调查早已发现,感染人类的HpV类型有200余种,其中高危险致癌HpV达13种,但仅高危型HpV16就占所有HpV病毒感染人类总和的约50%。这种现象背后的分子机理长期未能阐明。2019年,中国科学院大学生命科学学院马润林教授研究团队在HpV病毒致癌分子机制方面的研究中,首次揭示了高危险型HpV16病毒致癌蛋白E7能够通过直接结合寄主细胞微管相关蛋白4(MAp4)的C端来延缓宿主细胞的有丝分裂进程(图1),研究发现细胞MAp4是HpV16致癌E7蛋白的一个新的靶点分子,在有丝分裂过程中与HpV16E7结合并将其招募到与纺锤体微管上。研究还发现HpV16E7蛋白通过抑制MAp4磷酸化介导的降解来增强MAp4的稳定性,从而增加微管聚合的稳定性,显著延长宿主细胞有丝分裂进程(图2)。这种延长有利于病毒DNA整合到宿主细胞染色体内。进一步深入研究发现调控细胞分裂的关键蛋白MpS1就是MAp4的激酶,E7-MAp4结合阻断了MpS1对MAp4的磷酸化,从而阻断了依赖于磷酸化的MAp4降解。
该研究揭示了HpV16E7通过干扰MpS1-MAp4级联信号途径来干扰宿主有丝分裂进程的分子机制,从而延长感染窗口,并可能促进HpV16的持续感染。由于同是高危险型的HpV18E7不能够与MAp4形成紧密结合,该研究为HpV16病毒为什么能够在自然感染人群中占有如此之高的频率提供了科学的解释。研究论文于2019年6月28在日国际癌症研究主流杂志《Oncogene》(影响因子6.29)上在线发表,文章链接为https://www.nature.com/articles/s41388-019-0851-1。马润林教授研究团队的博士生郭羽和助理研究员张晓娟为该文章的共同第一作者,马润林教授为通讯作者。相关研究得到国家自然科学基金项目的资助。
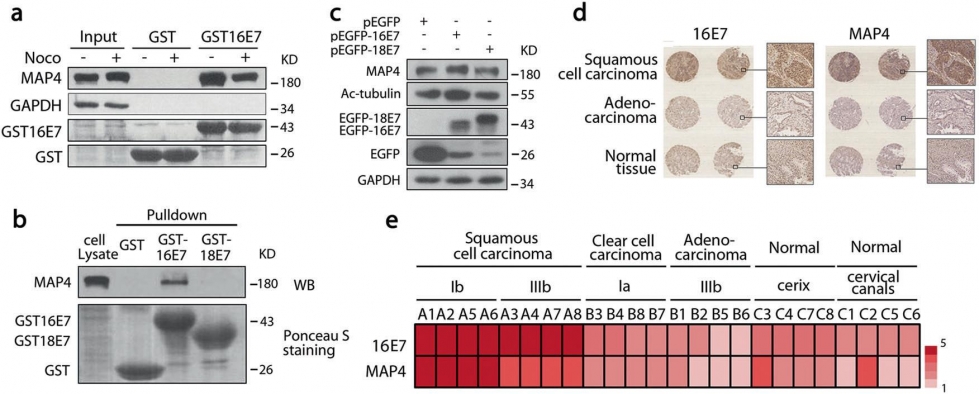
图1. HpV16 E7通过与MAp4结合诱导MAp4蛋白水平增加
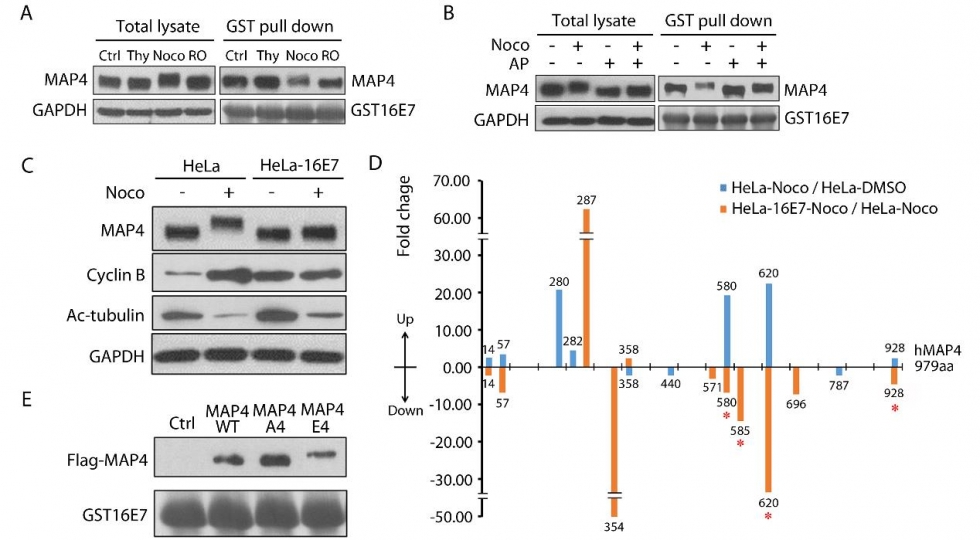
图2. HpV16 E7通过与MAp4 的相互作用降低MAp4的磷酸化水平
马润林教授团队从事免疫功能基因组学及分子遗传学研究。2019年以来,马润林研究组还成功绘制了珍惜野生动物旋角羚主要组织相容性复合体(MHC)区域基因组高密度BAC物理图谱,为反刍动物MHC区域结构的保守性及进化提供了新证据,相关论文于2019年6月11日在《BMC Genomics》杂志(影响因子3.8)上在线发表。马润林还与国家疾控中心张永振研究组合作,发现了中国鼩鼱中高度分化的嗜肝DNA病毒,相关成果于2019年3月11日发表在《Virology》杂志(影响因子3.29)。马润林组还参与了美国基于网络计算方法预测小鼠组胺超敏反应的候选基因研究,相关成果于2019年12月1日在《G3-Genes Genomes Genetics》杂志(影响因子2.71)上在线发表。此外,马润林研究组还参与了根据SHON表达情况预测乳腺癌患者的反应和复发风险的研究工作,相关成果于2019年2月28日发表在《British journal of cancer》杂志(影响因子5.92)。