三阴性乳腺癌(TNBC)是最具侵袭性的乳腺癌类型。因为它不表达激素受体和HER2,所以不能使用靶向治疗。长期以来,TNBC患者只能接受手术和放化疗。
免疫检查点抑制剂治疗的出现给TNBC患者带来了新的希望,但临床试验发现pD-1抑制剂联合化疗只能使小部分TNBC患者受益[1,2]。因此,探索TNBC对免疫检查点抑制剂治疗耐药的机制至关重要,为提高免疫治疗效果提供参考。
最近,Dana-Farber癌症中心Judith Agudo教授领导的研究小组在《Cell[3]》杂志上发表了重要的研究成果。
他们发现在TNBC中有一组静止的肿瘤细胞(QCCs)能够抵抗T细胞的杀伤。这些QCCs与免疫抑制的成纤维细胞和功能失调的DC细胞一起,形成一个微环境,通过激活HIF1a来抵抗T细胞的浸润和杀伤。从而存活免疫治疗并导致肿瘤复发。
本研究结果揭示了乳腺癌免疫逃逸的奥秘,凸显了QCCs在乳腺癌免疫逃逸中的重要作用,并提示靶向清除QCCs可能是解决TNBC免疫抵抗问题的有效途径。

已有研究发现某些基因在肿瘤细胞免疫治疗耐药中发挥作用[4,5],但这些研究无法解释肿瘤细胞如何形成免疫抑制微环境;然而,肿瘤组织中存在着大量的异质性细胞群,这大大增加了寻找肿瘤耐药机制的难度。例如,失去肿瘤抗原的癌细胞和肿瘤抗原阳性的癌细胞采取不同的途径逃离免疫系统。
在这项研究中,Agudo教授的团队想要探索表达肿瘤抗原的癌细胞是如何逃离免疫系统的。因此,他们将表达GFp或mCherry的TNBC细胞系4T07接种给小鼠,并向小鼠输血特异性识别GFp的pD-1-/- jedi T细胞(pD-1敲除是为了模仿pD-1抑制剂治疗)。
因为绝地T细胞的TCR只能特异性识别GFp而不能识别mCherry。因此,该实验模型可用于探索连续表达肿瘤特异性抗原(GFp+肿瘤细胞)的肿瘤细胞如何逃避肿瘤抗原特异性T细胞(Jedi T细胞)的攻击。
研究小组在输入Jedi T细胞后的第5天,分析了肿瘤中GFp+和mCherry+肿瘤细胞的比例,发现Jedi T细胞杀死了大部分GFp+肿瘤细胞,但仍有部分GFp+肿瘤细胞逃脱了T细胞的杀死。
免疫荧光染色显示,这些逃逸的GFp+肿瘤细胞形成了一个细胞簇,其中T细胞浸润水平降低了2倍。
这提示存活的GFp+肿瘤细胞簇可以阻止T细胞浸润,这可能是它们对免疫治疗产生抵抗的原因之一。
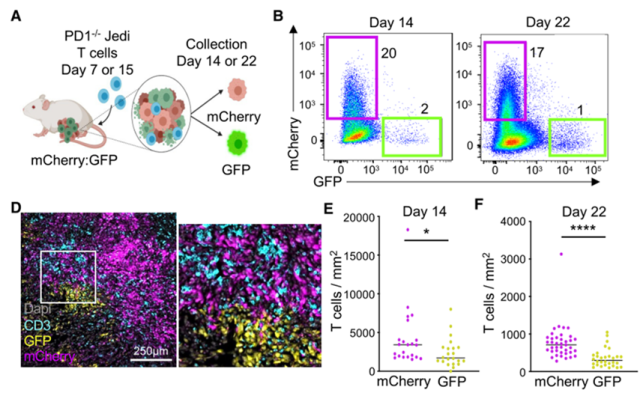
存活的GFp+肿瘤细胞在绝地T细胞挑战后聚集
接下来,Agudo教授的团队分析了存活的GFp+肿瘤细胞和对照mCherry+肿瘤细胞之间的转录组差异。
他们发现,与mCherry+肿瘤细胞相比,GFp+肿瘤细胞中与细胞周期相关的基因显著下调。EdU (thymidine analog 5-ethynyl-20-deoxyuridine)掺入实验表明,这些GFp+肿瘤细胞在绝地T细胞的攻击下存活,处于细胞周期停滞状态(称为静止肿瘤细胞,QCCs)。
那么这些qcc对T细胞的杀伤有更强的抵抗力吗?研究小组将tdTomato- p27k转移到肿瘤细胞中,使QCCs能够被tdTomato标记。
将pD-1-/- Jedi T细胞输注到荷瘤小鼠体内后发现,与对照非免疫原性miRFp670+肿瘤细胞相比,大多数存活的GFp+肿瘤细胞是tdTomato+,这表明QCCs对T细胞没有影响。杀戮具有更强的抵抗性。
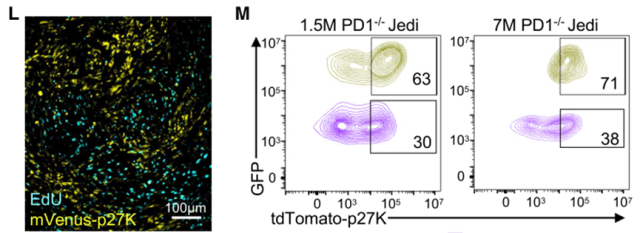
在绝地T细胞挑战中幸存下来的GFp+肿瘤细胞处于细胞周期静止状态,对T细胞杀伤具有更强的抵抗力
以上结果表明,在小鼠模型中,qcc是免疫治疗抵抗的主要力量。这种现象在人类病人身上也存在吗?
研究小组通过对乳腺癌患者的组织病理学样本和转录组测序分析发现,肿瘤组织中与T细胞接触的肿瘤细胞多为Ki67+增殖细胞,而p27+ QCCs很少与T细胞接触;聚类分析显示,免疫治疗应答患者的肿瘤细胞比治疗无效患者的肿瘤细胞DNA复制相关通路更丰富,提示肿瘤细胞处于非静止状态。
这一相关性提示QCCs可能与乳腺癌患者免疫治疗效果差有关。
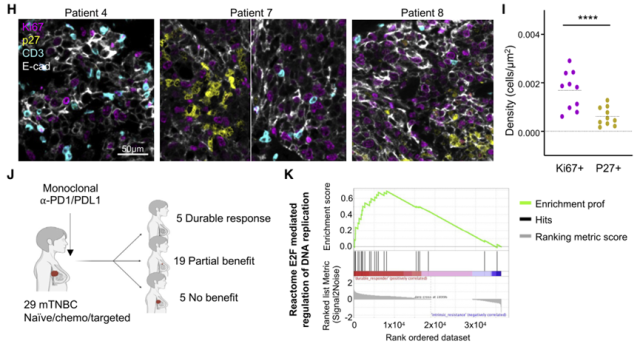
在乳腺癌患者肿瘤组织中,静息期肿瘤细胞周围的T细胞浸润较少,对免疫治疗有反应的患者肿瘤细胞处于细胞周期活跃状态
为了探索QCCs的耐药机制,课题组对QCCs和非静止肿瘤细胞进行了RNA测序。
数据分析显示,QCCs上调缺氧和糖代谢相关通路基因。
免疫荧光染色显示p27K+ QCCs与缺氧探针共定位,而T细胞很少渗入缺氧区;在绝地T细胞治疗中幸存下来的GFp+肿瘤细胞也位于缺氧区域。
这些数据表明乳腺癌中的QCCs主要位于低氧微环境中,T细胞浸润较少。
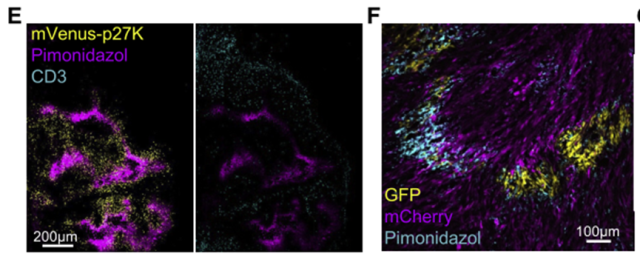
QCCs所在区域明显缺氧,T细胞浸润较少
接下来,分析QCCs在单细胞水平上抑制T细胞功能的机制。
Agudo的团队分离了QCCs细胞簇内外的浸润细胞,并进行了单细胞转录组测序。
通过数据分析,我们发现在QCCs细胞簇中存在大量的免疫抑制成纤维细胞,这就解释了为什么QCCs区域浸润T细胞的数量较少。
对浸润在QCCs细胞簇内外的T细胞进行分析发现,浸润在低氧QCCs细胞簇内的CD8+ T细胞耗竭更深,杀伤能力较弱。
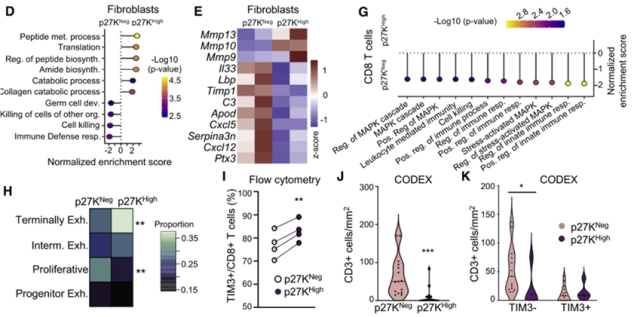
在QCCs细胞簇中存在大量免疫抑制的成纤维细胞,浸润T细胞的数量明显低于QCCs细胞簇外,浸润T细胞在QCCs细胞簇中更加枯竭
哪些细胞群导致了T细胞功能障碍?通过对QCCs中每个浸润细胞亚群的缺氧特征进行评分,研究团队发现DC细胞表达了大量的缺氧相关基因,并下调了促进T细胞活化的基因,如MHC I和MHC II、IL-12、CD80/86、研究表明,这些DC细胞促进T细胞活化的能力大大减弱,这可能是T细胞浸润QCCs细胞簇内功能障碍的重要原因。
但是,Agudo教授团队通过缺氧诱导实验发现,缺氧不会直接影响DC细胞激活T细胞的能力,因此,研究团队将目光转向了QCCs本身。
探讨表达hif1的QCCs是否形成免疫抑制微环境,削弱DCs激活T细胞的能力,从而抑制T细胞的免疫应答。为此,他们构建了表达活化HIF1a (HIF1a STBL)的乳腺癌细胞系。
荷瘤实验显示,与WT肿瘤相比,表达HIF1a STBL的肿瘤浸润T细胞更少,耗损更深;肿瘤内DC细胞中MHC II表达显著下调,与QCCs细胞簇中观察到的情况一致。基本上是一样的。
此外,研究小组将WT或HIF1a表达STBL的GFp+肿瘤细胞与mCherry+肿瘤细胞混合皮下接种小鼠。
结果发现,与mCherry+:GFp+肿瘤组相比,接种mCherry+:GFp+ HIF1a STBL肿瘤细胞的小鼠瘤内浸润T细胞较少,T细胞对GFp+肿瘤细胞的可及性较低,存活的GFp+肿瘤细胞数增加数倍。可见HIF1a可以促进肿瘤细胞的免疫逃逸。
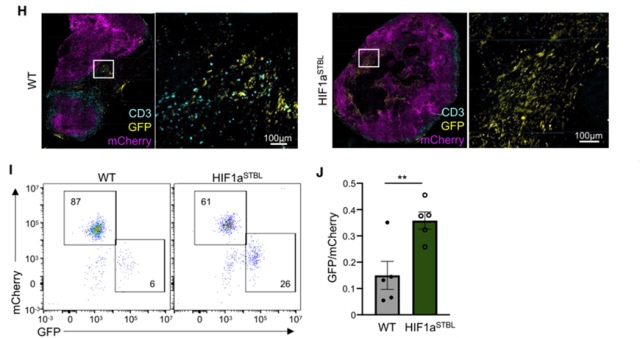
肿瘤细胞过表达HIF1aSTBL可以抑制T细胞浸润,逃避T细胞攻击
通过以上数据可以看出,QCCs通过HIF1a的高表达创造了一个免疫抑制的微环境,避开了肿瘤抗原特异性CD8+ T细胞的追逐。那么,在肿瘤细胞中敲除HIF1a能促进T细胞杀死肿瘤吗?
实验结果显示,肿瘤细胞敲除HIF1a后,肿瘤内浸润T细胞数量明显增加,衰竭程度降低,肿瘤体积明显减小。
提示靶向HIF1a在肿瘤中可促进抗肿瘤免疫反应,抑制肿瘤生长。
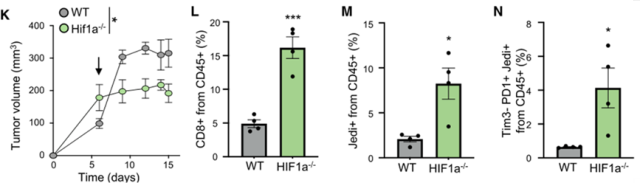
在肿瘤细胞中敲除HIF1a可显著增强抗肿瘤免疫反应
总的来说,这项研究揭示了肿瘤抗原阳性癌细胞逃避免疫的机制:它们聚集成簇并召唤成纤维细胞为它们建立屏障;它们一起进入静止状态并过表达HIF1a,使哨兵dc细胞的免疫系统功能失调,从而抑制t细胞的免疫反应。这些努力使它们能够逃离T细胞,并在免疫治疗后卷土重来。
同时,本研究结果也提示,根除QCCs是提高TNBC免疫治疗效果、防止肿瘤复发的关键。